钝化了的铝不能和什么反应?优艾设计网_设计百科?
覃天 2021-03-30 08:39 1.钝化:所谓钝化,就是使金属表面产生一层致密的氧化膜薄膜,而氧化膜的化学性质远比原金属稳定。在这层氧化膜的保护下,金属和外界的氧化剂隔离,从而使被钝化的金属化学性质“变得”不活泼。2.钝化了的铝表面:被钝化的铝表面上有一层致密的氧化铝(Al2O3)薄膜。3.氧化铝的分类:氧化铝并不指单一的物质,它有九种结晶体:χ型、β型、γ型、δ型、α型、κ型、ρ型、θ型、η型;常见的是α型氧化铝晶体、γ型氧化铝晶体,α型是白色原子晶体,γ型是白色离子晶体。α型属于六方最密堆积,它的熔点、硬度高,不溶于浓酸,耐腐蚀,绝缘性好。钝化的铝表面生成的薄膜具有多种晶格类型,含有部分α型氧化铝晶体,而根据薄膜物理的研究,它的纯在使薄膜的性质偏向于“不溶于浓酸、浓碱,延展性好,硬度高”,其实还是可以溶于浓酸(如浓盐酸)、浓碱(如氢氧化钠)的。4.浓硫酸、浓硝酸的性质:浓酸和稀酸不同,稀酸中有大量电离的H+离子,而浓酸中主要是H2SO4、HNO3分子,它们具有极强的氧化性,导致氧化铝薄膜的表面铝离子电位比溶液中的H+电位高,由表面化学的研究可知,这时表面AL+和H+电化学置换速度不及H+和AL+的置换速度,即不反应。而AL原子内的电子最外层仅3电子,浓H2SO4、浓HNO3的电势不足以使AL第二层电子脱离,所以AL3+为稳定态,不会和浓H2SO4、浓HNO3反应。5.NaOH溶液溶解Al2O3的原理:作为强碱,NaOH分子在溶液中电离的方程式:NaOH=Na+ +OH-电离度很大,所以溶液中含有大量的OH-,表现出强烈的还优艾设计网_PS交流原性,而Al2O3具有氧化性(Al单质、Al(OH)3、Al2O3等都具有两性),从而发生化学反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O,全反应:Al2O3+H2O=(可逆)2AlO2- +2H+,H+ +OH-=H2O,OH-不断消耗H+,使第一步的Al2O3水解反应一直向右进行。钝化的薄膜被溶解。6.NaOH溶液溶解Al反应:2 Al+2NaOH+2H2O=2NaAlO2+3H2↑ 全反应:2Al+6H2O=2Al(OH)3+3H2↑ ,Al(OH)3+NaOH=NaAlO2+2H2O 钝化的薄膜溶解后铝继续溶于NaOH溶液。
陈佳文 2021-03-30 08:43 优艾设计网_设计圈 被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜不会被浓硝酸和浓硫酸溶解,却可以被稀的稀硝酸和稀硫酸溶解.你所给的另两种物质,氢氧化钠也可以把它溶解,因为氧化铝具有两性:Al2O3 + 2NaOH = NaAlO2 + 2H2O而硝酸铜是不能把这一层氧化膜溶解的,如果没有这层氧化膜,那么铝当然会与硝酸铜反应,因为铝在金属活动性中,是排在铜的前面,可以把铜从溶液中置换出来.但由于有这一层氧化膜的阻止,硝酸铜不能与被钝化过的铝反应.
李嘉星 2021-03-30 08:55 不能和硝酸铜反应。被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜可以被稀的稀硝酸和稀硫酸溶解.你所给的另两种物质,氢氧化钠也可以把它溶解,因为氧化铝具有两性:Al2O3 + 2NaOH = NaAlO2 + 2H2O而硝酸铜是不能把这一层氧化膜溶解的,如果没有这层氧化膜,那么铝当然会与硝优艾设计网_PS问答酸铜反应,因为铝在金属活动性中,是排在铜的前面,可以把铜从溶液中置换出来.但由于有这一层氧化膜的阻止,硝酸铜不能与被钝化过的铝反应.
徐宝才 2021-03-3优艾设计网_Photoshop交流0 09:03 被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜不会被浓硝酸和浓硫酸溶解,却可以被稀的稀硝酸和稀硫酸溶解.
覃天 2021-03-30 08:39 1.钝化:所谓钝化,就是使金属表面产生一层致密的氧化膜薄膜,而氧化膜的化学性质远比原金属稳定。在这层氧化膜的保护下,金属和外界的氧化剂隔离,从而使被钝化的金属化学性质“变得”不活泼。2.钝化了的铝表面:被钝化的铝表面上有一层致密的氧化铝(Al2O3)薄膜。3.氧化铝的分类:氧化铝并不指单一的物质,它有九种结晶体:χ型、β型、γ型、δ型、α型、κ型、ρ型、θ型、η型;常见的是α型氧化铝晶体、γ型氧化铝晶体,α型是白色原子晶体,γ型是白色离子晶体。α型属于六方最密堆积,它的熔点、硬度高,不溶于浓酸,耐腐蚀,绝缘性好。钝化的铝表面生成的薄膜具有多种晶格类型,含有部分α型氧化铝晶体,而根据薄膜物理的研究,它的纯在使薄膜的性质偏向于“不溶于浓酸、浓碱,延展性好,硬度高”,其实还是可以溶于浓酸(如浓盐酸)、浓碱(如氢氧化钠)的。4.浓硫酸、浓硝酸的性质:浓酸和稀酸不同,稀酸中有大量电离的H+离子,而浓酸中主要是H2SO4、HNO3分子,它们具有极强的氧化性,导致氧化铝薄膜的表面铝离子电位比溶液中的H+电位高,由表面化学的研究可知,这时表面AL+和H+电化学置换速度不及H+和AL+的置换速度,即不反应。而AL原子内的电子最外层仅3电子,浓H2SO4、浓HNO3的电势不足以使AL第二层电子脱离,所以AL3+为稳定态,不会和浓H2SO4、浓HNO3反应。5.NaOH溶液溶解Al2O3的原理:作为强碱,NaOH分子在溶液中电离的方程式:NaOH=Na+ +OH-电离度很大,所以溶液中含有大量的OH-,表现出强烈的还优艾设计网_PS交流原性,而Al2O3具有氧化性(Al单质、Al(OH)3、Al2O3等都具有两性),从而发生化学反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O,全反应:Al2O3+H2O=(可逆)2AlO2- +2H+,H+ +OH-=H2O,OH-不断消耗H+,使第一步的Al2O3水解反应一直向右进行。钝化的薄膜被溶解。6.NaOH溶液溶解Al反应:2 Al+2NaOH+2H2O=2NaAlO2+3H2↑ 全反应:2Al+6H2O=2Al(OH)3+3H2↑ ,Al(OH)3+NaOH=NaAlO2+2H2O 钝化的薄膜溶解后铝继续溶于NaOH溶液。
陈佳文 2021-03-30 08:43 优艾设计网_设计圈 被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜不会被浓硝酸和浓硫酸溶解,却可以被稀的稀硝酸和稀硫酸溶解.你所给的另两种物质,氢氧化钠也可以把它溶解,因为氧化铝具有两性:Al2O3 + 2NaOH = NaAlO2 + 2H2O而硝酸铜是不能把这一层氧化膜溶解的,如果没有这层氧化膜,那么铝当然会与硝酸铜反应,因为铝在金属活动性中,是排在铜的前面,可以把铜从溶液中置换出来.但由于有这一层氧化膜的阻止,硝酸铜不能与被钝化过的铝反应.
李嘉星 2021-03-30 08:55 不能和硝酸铜反应。被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜可以被稀的稀硝酸和稀硫酸溶解.你所给的另两种物质,氢氧化钠也可以把它溶解,因为氧化铝具有两性:Al2O3 + 2NaOH = NaAlO2 + 2H2O而硝酸铜是不能把这一层氧化膜溶解的,如果没有这层氧化膜,那么铝当然会与硝优艾设计网_PS问答酸铜反应,因为铝在金属活动性中,是排在铜的前面,可以把铜从溶液中置换出来.但由于有这一层氧化膜的阻止,硝酸铜不能与被钝化过的铝反应.
徐宝才 2021-03-3优艾设计网_Photoshop交流0 09:03 被钝化的铝,表面有一层致密的氧化膜,这层氧化膜的主要成分就是氧化铝.这层氧化膜不会被浓硝酸和浓硫酸溶解,却可以被稀的稀硝酸和稀硫酸溶解.




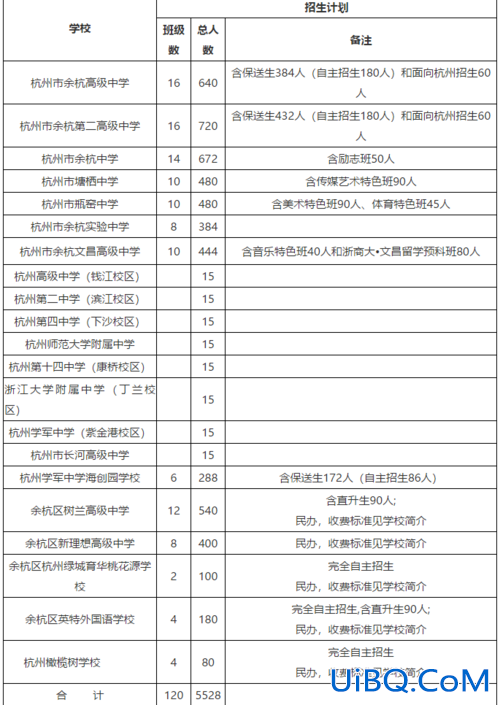
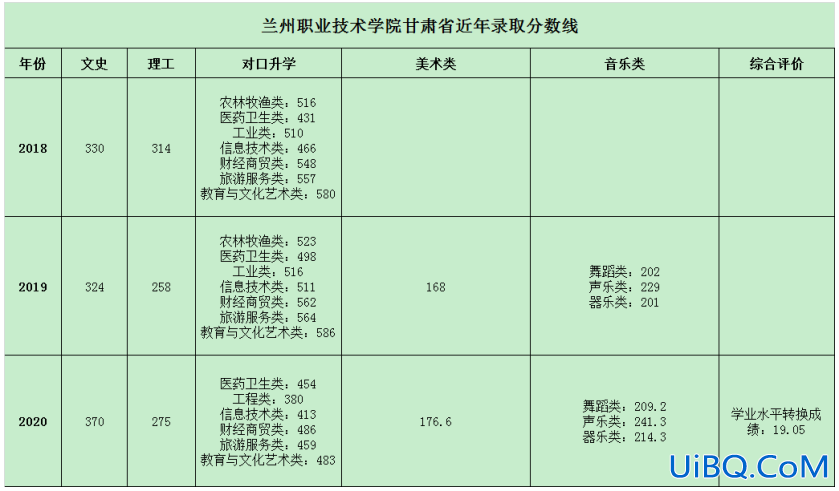


 加载中,请稍侯......
加载中,请稍侯......
精彩评论