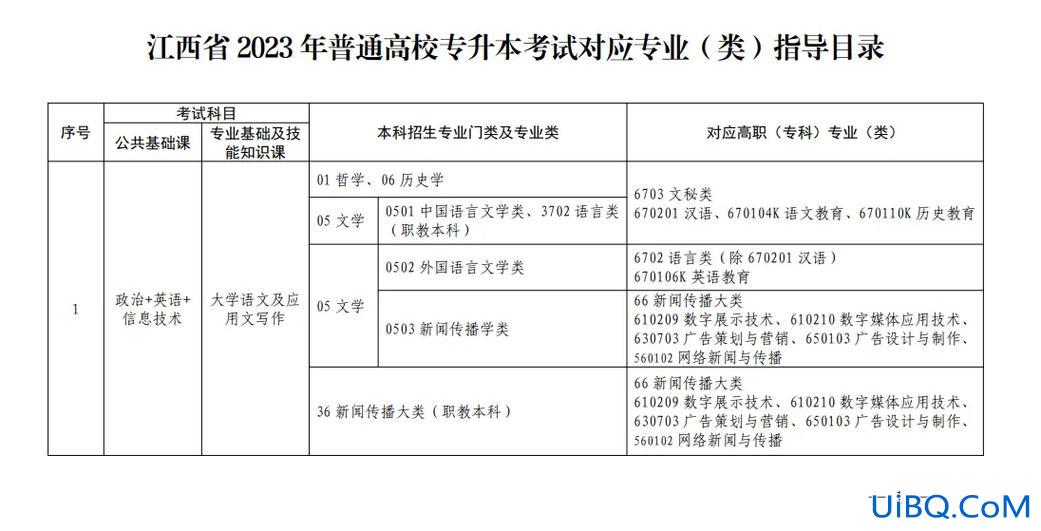
由于固体氢氧化钠和水溶解产生的大量放热,氨在水中的溶解度进一步降低,从而以气体形式溢出制备氨。以下是实验室制氨的化学方程式,供大家参考。
实验室制氨的化学方程式。在实验室中,氨通常通过铵盐与碱的反应或通过氮化物的水解来制备:
2NH4Cl Ca2===2NH3氯化钙2H2O
Li3N 3H2O===3LiOH NH3
实验室快速制备氨气的方法:
用浓氨水和固体氢氧化钠制备氨气。
工业氨是由N2和H2在催化剂存在下,通过哈伯法在高温高压下直接合成的;
N2 3H2==高温高压催化剂==2nh3
rH=-92.4kJ/mol
吸入氨的危害说明氨的刺激性是有害浓度的可靠预警信号。但由于嗅觉疲劳,长期接触后难以检测到低浓度的氨。吸入是主要的接触方式。吸入氨气后的中毒表现主要包括以下几个方面。
轻度吸入氨中毒表现为鼻炎、咽炎、咽痛、声音嘶哑。氨进入气管和支气管可引起咳嗽、咳痰和痰中带血。
严重者咯血肺水肿,呼吸困难,咳出白色或血性泡沫痰,双肺大、中水泡。患者有咽痛、咳嗽、咳痰或咯血、胸闷和胸骨后疼痛。
我可以找到自己知识中的薄弱环节,在课前把这部分知识补上,以免成为上课的绊脚石。这样我们就能顺利理解新知识,相信实验室生产氨的化学方程式的实验方法和方程式是什么?这篇文章可以帮助你。在与好朋友分享时,我们也欢迎有兴趣的朋友一起讨优艾设计网_在线设计论。






 加载中,请稍侯......
加载中,请稍侯......
精彩评论